Prøvetaking av fisk
Finn riktig prøve og fremgangsmåte ut ifra situasjon eller sykdomsbilde.
Hvordan ta og behandle ulike prøvetyper.
- Generell prøvetaking fisk
Generelt om prøveuttak
Levende fisk, rogn, samt hel, død fisk sendes kun inn etter avtale med laboratoriet.Ved all sykdomsmistanke/uforklarlig dødelighet hos oppdrettsfisk skal det alltid tas ut
- organprøver fra 5 fisk på formalin (til histopatologisk undersøkelse),
- vev fra de samme 5 fiskene på RNAlater™ (til agenspåvisning) og
- bakterieutstryk fra hodenyre fra samme 5 fisker på blodagar og blodagar m/salt (til bakteriologisk undersøkelse).
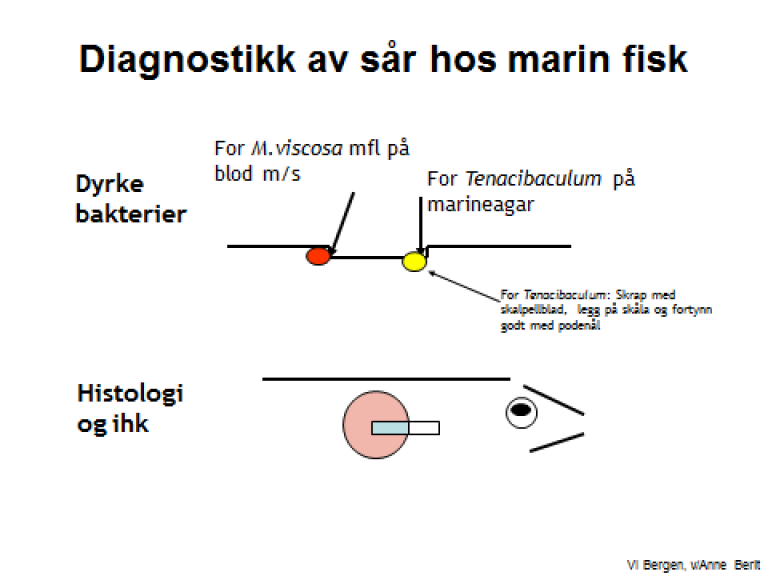
I tillegg gjøres det utstryk fra ytre lesjoner som sår (se figur) evt. finne-/haleråte på blodagar m/salt og marineagar fra fisk i sjøvann og på blodagar og Anacker og Ordals agar (AOA) fra fisk i ferskvann.
For meldepliktig sykdom kan det være utvidete prøveuttak, se under.
Formalinglass oppbevares i romtemperatur før og under innsending. Se «Send inn prøver» for pakking av prøvene før transport.
Prøver på RNAlater™ må ikke fryses før etter omlag ett døgn etter prøvetaking for å sikre tilstrekkelig konservering av materialet. Prøver på RNAlater™ kan sendes romtemperert eller kjølt.
Bakterieskåler sendes med eller uten vekst, kjølt.Her kan du se videosnutter om prøvetaking av fisk.
Mistanke om meldepliktig virussykdom
Ved mistanke om PD, ILA, VHS, IHN eller VNN (nodavirus) skal det tas ut- organprøver fra 10 fisker på formalin,
- vev fra de samme 10 fiskene på RNAlater™ og
- vev fra de samme 10 fiskene på virustransportmedium (gjelder all mistanke om ILA, VHS, IHN og VNN, men for PD gjelder dette kun ved mistanke i overvåkingssonene).
Se video om hvordan ILA-diagnostikken foregår.
Mistanke om meldepliktig/spesifikk bakteriesykdom
Ved mistanke om meldepliktig eller spesifikk bakteriesykdom listet i tabellen under, skal det gjøres utstryk på spesialmedium i tillegg til generelt prøveuttak. Evt. kan det etter avtale med laboratoriet sendes inn ferske nyrebiter/organbiter med lesjoner kjølt til laboratoriet.Bakterie
Prøveuttak
Renibacterium salmoninarum (BKD) – Liste 3
Generelt prøveuttak og utstryk fra hodenyre på Kidney disease agar (KDM/SKDM)
Aeromonas salmonicida subsp. salmonicida (furunkulose) – Liste 3
Generelt prøveuttak - ikke behov for spesialmedium
Flavobacterium psychrophilum, regnbueørret (flavobakteriose) –Liste 3
Generelt prøveuttak og utstryk fra hodenyre på Anacker og Ordals agar (AOA). Alternativt kan TYES (tryptone yeast extract salts) eller KDM brukes.
Francisella noatunensis subsp. noatunensis (francisellose) - Liste 3
Generelt prøveuttak og utstryk fra hodenyre på Cystein heart agar with blood (CHAB)
Mycobacterium sp. (mykobakteriose)
Generelt prøveuttak og utstryk fra hodenyre på Middlebrook agar
Ved mistanke om soppinfeksjoner
Ved mistanke om soppsykdommer (saprolegniose, svømmeblæremykose, nyresopp m.fl.) skal det tas kontakt med laboratoriet for å avtale innsending. Deretter skal det sendes hel fisk eller ferske vevsprøver med kjøling. - Anbefalt prøveuttak ved sykdomsutredning hos rensefisk
Fordi rognkjeks og de forskjellige leppefiskartene skiller seg fra laksefisk på flere områder, anbefaler vi et utvidet prøveuttak sammenlignet med laksefisk. Det er også viktig for Veterinærinstituttet å bygge opp kompetanse med tanke på normale variasjoner hos frisk fisk av de forskjellige rensefiskartene.
Medium Rognkjeks Leppefisk Antall 5 sjuke (eller nylig døde) og 3 friske* 5 sjuke,( eller nylig døde) og 3 friske* Bufret formalin
Øye
Hjerne (1/2)
Gjelle
Hjerte
Lever
Mage
Blindsekker
Baktarm
Nyre
Milt
Hud/muskel (ved sår, se figur)Øye
Hjerne (1/2)
Gjelle
Hjerte
Lever
«Mage»
Tarm
Nyre
Milt
Hud/muskel (ved sår, se figur)RNAlater Gjelle
Nyre
Hjerne (1/2)
Nyre og hjerne kan legges på samme rørGjelle
Nyre
Hjerne (1/2)
Nyre og hjerne kan legges på samme rørBlodskål m/salt Sår og nyre Sår og nyre Marineagar Sår og nyre Sår og nyre Virustransportmedium – avtales spesielt Nyre
Kan suppleres med hjerte og evt. milt dersom det er vanskelig å få nok nyremateriale
Kan legges i samme glassNyre
Kan suppleres med hjerte og evt. milt dersom det er vanskelig å få nok nyremateriale
Kan legges i samme glassSprit 70 -96% r Parasitter Parasitter *Undersøkelse av prøvene fra frisk fisk faktureres ikke
Fet skrift angir de organprøvene som alltid bør være med. I forbindelse med atferd som tyder på at det kan være forstyrrelser i sentralnervesystemet, må prøver fra hjerne og øye tas ut, for å kunne utelukke VHS, nodavirusinfeksjon eller andre infeksjoner eller skader i hjernen.
Utstryk fra sår
På marine agar: Ta materiale fra overflaten av såret mot sårkanten, ikke under sårkant.
Det er viktig å fortynne veldig godt (max en fisk per skål) (se figur).På blodagar m/salt: Brenn av podenåla, avkjøl podenåla i innstikkstedet og stikk innunder huden i kanten av såret.
Opplysninger på EPI - innsendelsesskjema
Dersom det sendes inn prøver fra flere arter samtidig, må det fylles ut ett skjema for hver art.
Anamnese: Må også inneholde utsettstidspunkt og dødelighet, resultat av parasittundersøkelser og om det er flere rensfiskarter i anlegget.
Stamme: Oppgi om rensefisken er i eller kommer fra settefiskanlegg, er villfanget, står i matfiskanlegg eller fra oppsamlingsanlegg før levering.
Vaksinasjon: Vaksinetype og tidspunkt for vaksinering er viktig.
Fysiologisk stadium:
Unge brukes dersom prøvene kommer fra settefiskanlegg.
Voksen brukes om rensefisk på arbeid i merd, eller i oppsamlingsmerd.Lengde og vekt er også viktig å få med.

- Prøver for kvantifisering Saprolegnia
Ta kontakt med laboratoriet i forkant, for optimalt resultat må prøver håndteres raskt og forutsetter derfor ledig kapasitet.
Analysen krever at prøver tas ut samme dag som de sendes. Send prøver kjølig (på is eller med kjøleelement) som ekspress over natt til Veterinærinstituttets gateadresse (ikke postboks adresse).
MERK! Prøver må meldes inn til laboratoriet senest tirsdag før kl. 11:00 og være mottatt senest onsdag formiddag for at analysen skal settes opp før helgen. Prøvene må da sendes med ekspress over natt senest tirsdag.
Prøvene sendes til
- Seksjon for mykologi, Veterinærinstituttet, Arboretveien 57, 1433 Ås.
Slik tar du ut prøver
- Bruk velegnede, sterile prøveflasker for vann, ca 250 ml. IKKE bruk flasker for celledyrkning.
- Merk prøver godt (nummer eller annen ID).
- Vedlegg også informasjon om følgende:
Rekvirent
Eier/lokalitet
Kunde/betaler
Uttaksdato
Innsenders referanse (brukes på faktura)
Antall innsendte prøver. - Informasjon sendes fortrinnsvis sammen med prøven eller per e-post. Det er viktig at pakken med innsendt prøvemateriale er godt merket med «innsenders referanse» og avsender.
Kontakt oss
- Prøver på formalin
Det skal være ett individ per beholder med formalin, og forholdet vev:formalin skal være minimum 1:10.
NB! Merk beholder med individnummer og opplys på elektronisk innsendelsesskjema hvilke organer som sendes fra hvert individ.
Slik tar du ut prøver
- Ta ut skiveformede vevsbiter (0,4x1x1 cm), lag plane snittflater der det er mulig og unngå å klemme vevsbiten med pinsett eller annet.
- Ved makroskopiske lesjoner: Prøven tas ved overgang fra friskt vev til forandret vev.
- Merk at ved sentralnervøse symptomer, mistanke om VHS eller nodavirus skal alltid hjerne sendes inn.
- Merk at hvis mekanisk avliving gir skade på relevant vev, eller fisken er liten (< 4 cm) skal avliving skje med overdose av bedøvelsesmiddel.
Fra hvert individ tas
- Milt
- Lever
- Blindtarm m/pankreas
- Rognkjeks: Ta også ut mage og baktarm
- Leppefisk: Ta også ut «mage» og tarm
- Gjeller: Gjellebue nummer to (større fisk: 2-3 cm av gjellebuen nedenfor vinkelen).
- Hjerte: Hele organet (for-, hjertekammer og bulbus arteriosus).
- Større fisk: Orienter hjertet med spissen mot deg og bulbus fra deg og legg et vertikalsnitt gjennom for- og hjertekammer. Dersom mulig, også gjennom bulbus. - Nyre: Fikser hele organet eller en lengde på 1 cm fra midtnyret.
- Større fisk: Skjær ut en bit på tvers av midtnyret slik at kapselen er med.
- Torsk: Nyret ligger langt framme, disseker bort spiserøret først. - Hud/muskel: Ta ut en loddrett skive på tvers av sidelinjen under ryggfinnen for å inkludere både rød og hvit muskulatur.
For marin fisk, send også øye og hjerne.
- Øye: Fikseres helt på ubufret 10 % formalin.
- Hjerne (NB! Ikke slå fisken i hodet! Avliv med overdose av bedøvelsesmiddel):
- Mindre fisk: Kløyv hodet vertikalt litt til side for midten. Fikser den største halvdelen med hjernen liggende i skallen.
- Stor fisk: Hjernen dissekeres ut og fikseres hel.
Liten fisk og yngel må avlives med overdose av bedøvelsesmiddel før fiksering
- Yngel
- Yngel >5 mm tykk: Fjern gjellelokk på én side, snitt i bukens midtlinje så fiksativet trenger inn.
- Prøver på RNAlaterTM
Det skal være ett individ per rør med RNAlater™. Husk å merke rørene med individnummer.
- Størrelsen på vevsbitene skal til sammen ikke overstige 1:10 av RNAlater volumet. Hver enkelt bit må være mindre enn 0.5 cm tykk for effektiv fiksering, men lengden kan være opptil 1 cm.
- Fra hvert individ tas prøver aseptisk fra følgende organer
- Nyre, hjerte
- Ved sentralnervøse symptomer og mistanke om VHS eller nodavirus skal også hjerne prøvetas.
- Prøver på virustransportmedium
Prøvene bør sendes samme dag, nedkjølt og på raskeste måte (over natt) slik at de ankommer laboratoriet påfølgende dag. Dersom is/snø brukes som kjøling, må pakken sikres mot avrenning av smeltevann. (Dersom det renner vann ut av pakken, vil Posten ta ut pakken for ompakking.)
Prøver på virustransportmedium skal fortrinnsvis tas ut mandag, tirsdag eller onsdag da cellekulturundersøkelsen bør starte innen 48 timer etter prøveuttak. Unntaksvis (vanskelige værforhold etc.) kan inntil 72 timer aksepteres. Dersom prøver MÅ tas torsdag eller fredag, skal laboratoriet (Veterinærinstituttet Oslo, tlf. 46 85 76 95) kontaktes på forhånd for å avklare oppbevaring og innsending.
Slik tar du ut prøver
Det skal være vev fra ett individ per rør med virustransportmedium. Husk å merke rørene med individnummer.
- Fra hvert individ tas prøver aseptisk fra følgende organer, totalt 1 g vev per 9 ml virustransportmedium (10% v/v)
- Nyre, hjerte og eventuelt milt avhengig av agens/problemstilling - ta gjerne kontakt med laboratoriet på 46 85 76 95 på forhånd hvis tvil
- Hjerne og eventuelt øye skal også prøvetas ved sentralnervøse symptomer og ved mistanke om VHS eller nodavirus. - Prøveuttak av plommesekk- eller startfôringsyngel
- Kapp hode og hale (bak gattet) og fjern eventuell plommesekk. Legg hele fisken på sterilinglass med virustransportmedium. - Prøveuttak fra yngel over 6 cm
- Ta ut indre organer (kan tas ut sammenhengende, sørg bare for at milt, fornyre og hjerte er med i prøvematerialet). Forhold mellom organmateriale og transportmedium skal være ca. 1:10.
- Fra hvert individ tas prøver aseptisk fra følgende organer, totalt 1 g vev per 9 ml virustransportmedium (10% v/v)
- Prøvetaking ved screening for epizootic ulcerative syndrome (EUS)
Bruk elektronisk prøveinnsendelsesskjema (EPI).
Send prøven kjølig (på is eller med kjøleelement) som pakke over natt. Legg ved/skriv på EPI-registreringsnummer sammen med prøvene som sendes til Veterinærinstituttet, Seksjon for molekylærbiologi.
Slik tar du ut prøver
- Ta ut 30 fisk per fiskegruppe og to prøver per fisk (A og B).
- Ta fortrinnsvis prøver fra fisk med sår. Svimere og evt. frisk fisk kan brukes i fravær av sårproblemer og der formålet er å sannsynliggjøre fravær av EUS for eksportformål. - Merk 60 Eppendorfrør – 30 til A og 30 til B-prøver. Bruk om mulig 2ml rør med rund bunn. Disse kan bestilles ved Veterinærinstituttets utstyrsbestilling. Merk 1-30 på begge rør og legg i hver sin zip-lokk pose e.l. merket A og B.
- Ta ut 25-50 mg prøvemateriale («fystikkhode» størrelse) av skinn/muskel fortrinnsvis fra sårranden. For symptomløse fisk, maksimer flate skinn framfor å gå dypt i muskel.
- Legg prøven i tørt Eppendorfrør (IKKE RNA-later eller andre væsker), og frys prøvene før de pakkes.
- Beskriv hvilke prøvenummer som kommer fra fisk med sår, svimere og frisk fisk (f.eks. 1-10 sår, 11-20 svimere, 21-30 symptomløs)
Spørsmål om prøvetaking, innsendelse, svartid og/eller prøvesvar samt varsling av innsendelser sendes til:
116rutine@vetinst.no med kopi til torfinn.moldal@vetinst.no
Veterinær Torfinn Moldal kan også kontaktes på telefon 958 13 520 - Ta ut 30 fisk per fiskegruppe og to prøver per fisk (A og B).
- Prøvetaking ved screening for epizootisk hematopoietisk nekrosevirus (EHNV)
Bruk elektronisk prøveinnsendelsesskjema (EPI).
Prøver på transportmedium må sendes kjølig som pakke over natt. RNAlater-prøver er ikke avhengig av kjøling ved korte frakttider.
Legg ved/skriv på EPI-registreringsnummer sammen med prøvene som sendes til Veterinærinstituttet, Seksjon for virologi.
Undersøkelsesmetoder
- Isolering i cellekultur (analysetid 2,5 uker)
Isolering i cellekultur er fremdeles gullstandard for påvisning av EHNV i OIE-manualen, og denne undersøkelsen anbefales hvis mulig. Prøveuttaket bør derfor planlegges med tanke på dette. - PCR
Hvis det ikke er tid til å utføre isolering i cellekultur, tilbyr Veterinærinstituttet også en PCR for påvisning av EHNV.
Slik tar du ut prøver
- Ta ut 30 fisk per fiskegruppe.
- Ta fortrinnsvis prøver fra svimere og fersk dødfisk. Frisk fisk kan brukes i fravær av sykdom, og der formålet er å sannsynliggjøre fravær av EHNV for eksportformål.
- Utstyr for prøvetaking er rør med virustransportmedium (9 ml) til fisk (isolering i cellekultur) eller 1,5 ml Eppendorfrør med RNAlater (påvisning v/PCR).
- Ta ut en bit av lever, milt og nyre i samme rør – ett rør per fisk. Mengden prøvemateriale bør ikke overstige ca. 10 % av totalvolumet. Bitene som tas ut på virus transportmedium vil derfor være betydelig større enn de som tas ut på RNAlater.
- Beskriv hvilke prøvenummer som kommer fra fisk med sår, svimere og frisk fisk (f.eks. 1-10 sår, 11-20 svimere, 21-30 symptomløs)
Ved spørsmål om EHNV kontakt:
Viruslaboratoriet 46 85 76 95. E-post: virus@vetinst.no - Isolering i cellekultur (analysetid 2,5 uker)

